免疫组化已成为病理医师日常工作中不可缺少的一部分,如病变确诊、分类等均离不开免疫组化的帮助。随着靶向治疗的不断发展,免疫组化也已广泛用于靶向治疗患者的筛选、治疗效果的预测等。
近年来,CD30成为造血系统恶性肿瘤中备受关注的干预靶点。CD30是一种I型跨膜蛋白,其细胞外结构域具有6个模序,胞质内有1段可与多种肿瘤坏死因子结合的序列,而该序列可活化NF-κB及细胞外信号调节激酶信号通路。Brentuximab vedotin是一种抗体-药物耦联物,将抗CD30单克隆抗体和微管破坏剂联结起来而发挥抗肿瘤作用,因此免疫组化中均一、强阳性表达CD30的造血系统恶性肿瘤(如经典型霍奇金淋巴瘤、间变性大细胞淋巴瘤等)应用该药会具有较好效果;其他可能会表达CD30、但阳性程度及阳性比例不一的淋巴瘤(如弥漫大B细胞淋巴瘤、多种T细胞淋巴瘤等)中这一药物的效果仍在进一步研究中。不过,相关研究中采用的CD30阳性阈值及着色模式标准不一,这为进一步深入研究造成了一定困难。
为进一步探索CD30免疫组化染色中的技术差异及结果解读中的重复性问题,荷兰阿姆斯特丹大学学术医学中心Koens等进行了一项3轮的重复性评估实验,并撰写了相关文章发表于近期的《Histopathology》,我们择其要点编译介绍如下。
研究内容
选择20例福尔马林固定、石蜡包埋的淋巴造血系统恶性肿瘤标本制作组织微阵列,5微米切片后送荷兰的5家病理实验室按照该单位常规诊断流程进行CD30检测。肿瘤细胞阳性比例分别记为无阳性、0-2%、3-10%、11-20%、21-30%、31-50%、>50%;着色强度则分别记为无着色、程度不一的阴性-弱阳性、均一弱阳性、程度不一的弱阳性-强阳性、均一强阳性。
研究流程共3轮,第1轮为技术验证及免疫组化结果解读,分别由进行CD30免疫组化检测的5家实验室病理医师对结果进行评判;第2轮为荷兰造血系统恶性肿瘤CD30靶向治疗专家委员会25位医学专家通过屏幕对6例病例的典型图像进行评判;第1轮的医师均参与了该轮会议,同时在该轮中由研究者之一讲解了CD30免疫组化解读陷阱,具体涉及阳性细胞判定、技术问题、肿瘤细胞与周围细胞大小相同病例的解读等。
第3轮再次选择20个病例的苏木素-伊红染色、CD30免疫组化及其他相关免疫组化代表性图像,由参加过第二轮会议的15位医师对CD30免疫组化结果进行评分。
研究结果
第1轮
5个病理实验室通过不同的免疫组化机器、应用不同克隆号的抗体对组织微阵列切片进行CD30检测。即使同一克隆号的情况下,染色结果也有显著差异,阳性细胞百分比方面的配对一致性为46%;染色强度方面的配对一致性为56%。
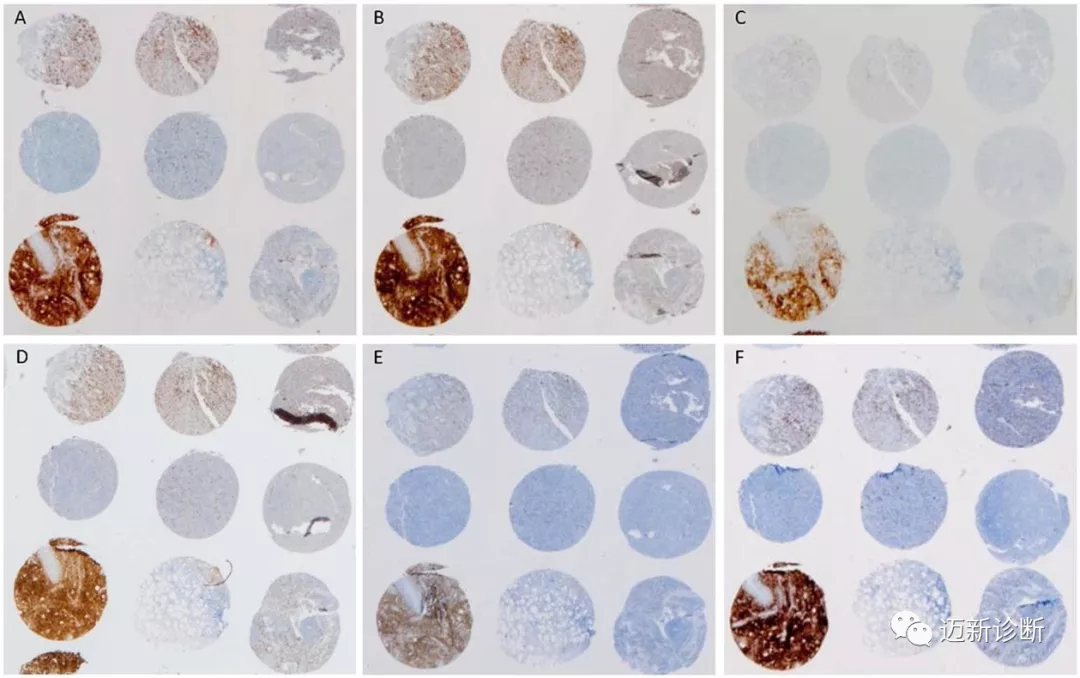
图1. CD30免疫组化在不同实验室因所用设备、抗体克隆号不同而染色结果明显不同。
第2轮
最初6个病例的CD30专家评估结果一致性较差;经研究者之一讲解了CD30免疫组化解读陷阱后,结果解读的一致性取得了一定进步。

图2. 专家讲解前后,第2轮中的6例免疫组化结果解读出现了较大差异,有些甚至是跨几个结果范畴的改变。
第3轮
本轮模拟真实的诊断过程,因此除HE染色、CD30染色外,还同时呈现了其他免疫组化指标(如CD20及CD3)结果。15位参加过第2轮培训的医师报告CD30结果。不同医师间CD30阳性结果的分布还是有很大差异的,部分医师所报告的CD30阳性结果显著高于其他人。肿瘤细胞阳性比例及着色强度间的一致性分别仅为33%、74%。相比第2轮培训结果而言,并无实质性改变。不过如将一个相邻结果范畴的差异视为一致,则CD30阳性比例的可重复性有了改善(一致性为71%)。结果一致性与医师的执业年限或受教育水平无关。
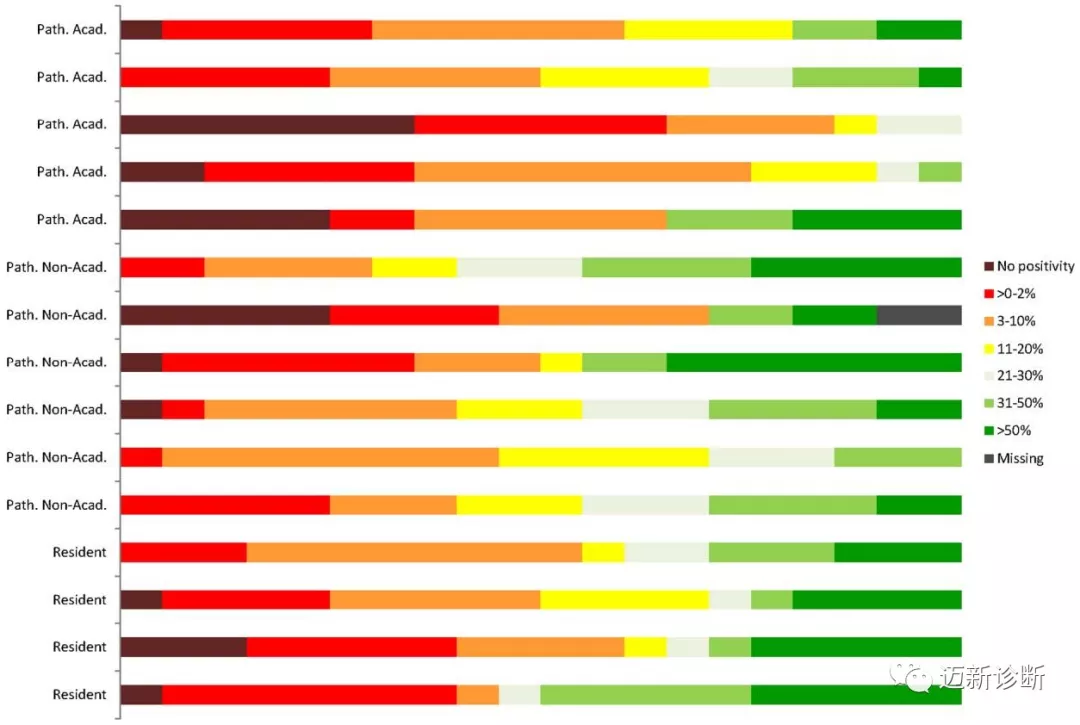
图3. 第3轮中15个病例每位医师的判断结果,结果差异较大,且部分医师容易评分过高。
选择2%与10%阳性作为阈值,一致性结果相对较好(阈值为2%时的一致性为78%,阈值为10%的一致性为76%)。阈值为2%时,20个病例中有5例被所有医师均判为阳性;阈值为10%时,20个病例中仅有6例达到了意见一致(3例CD30阴性、3例CD30阳性)。由于CD30结果涉及治疗决策,因此所选阈值不同、进而结果不同会影响患者是否可以纳入相关临床试验。如图4中病例,阈值为2%时,15位医师有11位判断为CD30阳性;而阈值为10%时,15位医师中仍有11位判断为CD30阳性。

图4. 本例为弥漫大B细胞淋巴瘤,图A、C、D分别为CD30、CD20及CD3。
小结
该研究结果表明,免疫组化检测CD30的可重复性并不理想。这一问题一方面是因为不同病理实验室所用免疫组化检测方法及抗体等有所不同,另一方面病理医师对结果的解读也缺乏一致性。经过相关培训后,一致性虽有改善但并未达到理想状态。这一问题可能会影响临床试验中对患者的筛选,进而影响CD30阳性肿瘤细胞数量与临床疗效之间相互关系的评估。
参考文献
Koens L,van de Ven PM,Hijmering NJ,et al.
Interobserver variation in CD30 immunohistochemistry interpretation; consequences for patient selection for targeted treatment[J].Histopathology,2018.
DOI:10.1111/his.13647