
上皮性卵巢癌由高级别浆液性 (70%)、子宫内膜样 (10%)、透明细胞 (10%)、低级别浆液性 (3.5%) 和黏液性 (3.6%)癌五种亚型组成。其中,黏液亚型的病理特征和临床表现与其他亚型不同,但在组织学上很难与转移性黏液结直肠癌区分。常用标志物CK20、CK7、CDX2的表达在原发性和转移性肿瘤中相似,目前,两个实体的区别主要由 SATB2 和 Pax-8 鉴别,同样,ER/PR 在少数原发性卵巢黏液肿瘤(<10%)中可呈弱阳性表达,但灵敏度较低。先前的研究表明 EMA (也称MUC1)和 MUC5AC 表达在黏液性肿瘤中的潜在诊断价值。因此,本研究验证和比较良性黏液性囊腺瘤、黏液性交界性肿瘤和黏液性癌的免疫组化标志物EMA 、MUC5AC、Pax-8的潜在诊断价值,并评估其表达与临床病理学参数的相关性和临床结果。
取自1985--2015年在慕尼黑大学慕尼黑分校妇产科接受上皮性卵巢癌妇科手术的108例患者标本,包括黏液性囊腺瘤26例,黏液性交界性肿瘤26例,黏液性卵巢癌45例,原因不明黏液性癌10例,进行二次重新评估后(图1),确定98例样本进一步评估与研究,分析了卵巢和结直肠组织样本Pax-8、CK20、CK7、CDX2、SATB2、ER/PR、EMA和 MUC5AC的表达,并对免疫反应性进行半定量评分。
图1. 病理检查过程图
对样本分类的再评价
由于样本包含源于1985年的旧组织,所以根据2020 WHO重新评估了所有(55例)原发黏液性卵巢癌和未知原发样本的组织学,发现与最初的诊断相比,亚型分布有所不同 (图2):10/55(18%)原诊断为原发黏液性卵巢癌或原因不明的黏液性卵巢癌被重新分类为转移性黏液性卵巢癌,起源于结直肠。
图2. 2020 WHO评估后黏液性卵巢癌和未知原发样本的组织学亚型改变
对40例原发黏液性卵巢癌和10例转移黏液性卵巢癌标本进行Pax-8、CK20、CK7、CDX2、SATB2和ER/PR检测,并增加 EMA 和 MUC5AC的IHC染色,结果观察到CK20 (p=0.062)、CDX2 (p=0.062)、ER (p=0.109)、PR (p=0.421) 和 MUC5AC (p=0.055) 在诊断原发性和转移性黏液性卵巢癌方面没有相关性。与预期一致,原发黏液性卵巢癌中 CK7 (p=0.0001) 和 Pax-8 (p=0.003) 的表达存在强相关性,且EMA (p=0.001) 表达显着增加(图3,A、B、C)此外,检测结果证实了 SATB2 (p = 0.0001) 与转移性黏液性卵巢癌之间的已知相关性。表明除 Pax-8、CK7、SATB2 外,EMA 也可成为区分原发性、转移性黏液性卵巢癌的可靠标志物。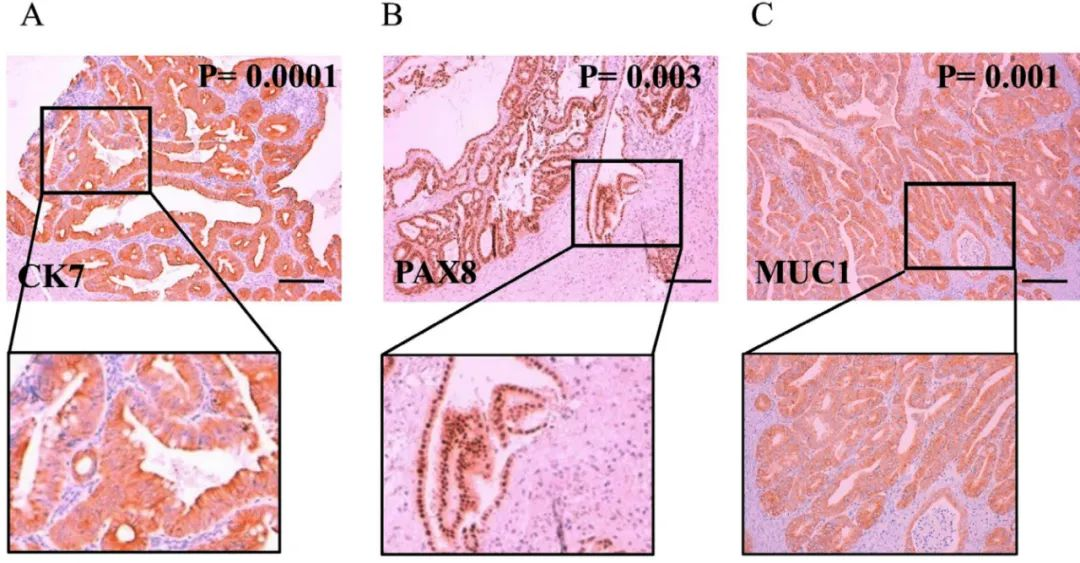
图3. 生物标志物表达与黏液性卵巢癌的强相关性。A:CK7 表达;B:Pax-8 表达;C:EMA 表达。
在确定标志物的表达是否与良性至恶性黏液性肿瘤的进展中,分析了卵巢黏液性腺瘤 (n=24)、黏液性交界性肿瘤 (n=24) 和黏液性癌 (n=40) 样本。观察到 MUC5AC 与三种肿瘤亚型之间呈强负相关 (p=0.001): 在87%腺瘤、75%交界性肿瘤中强表达,在黏液癌中低表达或不表达(图 4A 、B、C 和 D)。其他标志物的表达与肿瘤亚型无类似相关性。
图4. A-C: MUC5AC 从黏液性腺瘤 (A) 到黏液性交界性肿瘤 (B) 到黏液性卵巢癌 (C) 的表达降低;比例尺:200 µm。D: 三种亚型中 MUC5AC 表达的量化 (p=0.001)。2020 WHO 将间质浸润视为黏液性卵巢癌的一个重要预后因素。研究确定了40例样本的浸润类型:22 例为扩张性浸润(图 5A),18 例为破坏性浸润(图 5B)。
图5. 黏液性卵巢癌的扩张型和破坏性侵袭模式。比例尺:A=500微米,B=200微米
鉴于尚未针对卵巢癌这一特殊的组织学建立分级系统,分析应用了子宫内膜样癌进展的三级分级系统。发现12例肿瘤分级为1级(G1),23例为2级(G2),5例为3级(G3)。并发现破坏性侵袭与较高的肿瘤分级呈显著正相关(p=0.026χ2和p=0.006 Spearman‘sρ)。Pax-8的表达与较低的肿瘤分级显著正相关(p=0.016χ2和p=0.004 Spearman‘sρ)。Pax-8阳性的肿瘤被分类为G1和G2。提示Pax-8的表达和间质侵袭方式在鉴别G1/2和G3黏液性卵巢癌中具有诊断价值。研究分析生物标志物、肿瘤分级和间质浸润对总生存期的影响,发现G3患者的生存期显著低于G1患者(p=0.001),而与G2无相关性(p=0.602)(图 6A)。表明,与预后最差的 G3 患者相比,G1 患者预后较好。但对于大组 G2 (n=23),分级没有预后意义。图6B总结了存活率和间质侵袭间的相关性。与破坏性侵袭的肿瘤患者相比,扩张性侵袭肿瘤的患者存活时间明显更长(p = 0.006)。在单变量分析中,Pax-8 和 ER 表达与总生存期呈强正相关(分别为 p = 0.009 和 p = 0.026)(图 6C 和 D)。在多变量分析中,Pax-8 阴性和破坏性侵袭患者呈较差总生存期(分别为 p = 0.005 和 p = 0.015,表1)。
图6. Kaplan-Meier 分析曲线。A:肿瘤分级G1和G3总生存期具有显著差异 (p=0.013)。B:扩张性间质浸润的患者存活时间显著长于破坏性间质浸润患者 (p=0.006)。C-D:Pax-8和 ER 阳性的患者生存期显着延长 (p=0.026)。

先前的研究发现 EMA 在超过 90% 的卵巢癌晚期和转移性病变中过表达,但在正常卵巢组织不表达,这与本研究结果一致。此外,EMA的高表达与卵巢癌进展相关。区分交界性卵巢肿瘤和侵袭性卵巢癌是一大挑战,本研究发现超过 75% 的细胞对MUC5AC的免疫反应表明存在交界肿瘤。因此,交界性非浸润性癌中 MUC5AC 染色较弱表明肿瘤进展为浸润性癌,这增加了由生物标志物表达变化引发的从黏液性腺瘤到交界性肿瘤以及黏液性卵巢癌的进展新见解。虽然许多报告说肿瘤进展是由KRAS等触发的,但免疫组化可对测序受限的群体有利。探索肿瘤分级、肿瘤生长模式和免疫组化标志物与总生存率之间的关系有助于指导临床管理,本研究中,G3 女性的生存率显著低于 G1 女性。此外,与具扩张性侵袭的肿瘤相比,破坏性侵袭患者生存率较差。Pax-8与总生存期和较低的肿瘤分级呈正相关,表明这可能是预后和肿瘤分级的有用生物标志物。
95%扩张侵袭型癌的临床表现通常是低转移潜能、低复发风险和 I 期疾病,而约 17%–30% 的破坏亚型女性患者在诊断时出现淋巴结转移。15%–30%肿瘤患者出现破坏性侵袭,导致致命的复发,鉴于I期年轻患者希望保留生育能力,通常建议进行单侧输卵管卵巢切除术。本研究结果包括较高的肿瘤分级和破坏性侵袭作为病理参数,表明生存率较差,这可能导致对保留生育力手术的患者进行更严格的选择,还需要进一步的临床验证。本研究引入跨膜黏蛋白家族的 EMA 和 MUC5AC作为黏液性卵巢癌的潜在生物标志物:① EMA作为区分结直肠起源的黏液性卵巢癌和原发黏液性卵巢癌的新标志物;② MUC5AC 作为肿瘤从良性到侵袭性肿瘤进展的标志物;③ Pax-8 阳性表达与更好的临床预后相关,表明对黏液性卵巢癌患者具有积极的预后价值;这些结果可用于改善原发黏液性卵巢癌的诊断,并优化早期疾病患者的保留生育能力手术,这是妇科癌症协会 (GCIG) 确定的黏液性卵巢癌四个关键研究领域中的两个。抗体名称 | 产品编号 | 克隆号 | 细胞定位 |
EMA | Kit-0011 | E29 | 胞质/胞膜 |
MUC5AC | MAB-0079 | 45M1 | 胞质 |
Pax-8 | MAB-0837 | MX062 | 胞核 |
参考文献:
[1] ChelariuRaicu Anca, Holley Eva, Mayr Doris, et al. A combination of immunohistochemical markers, MUC1, MUC5AC, PAX8 and growth pattern for characterization of mucinous neoplasm of the ovar [J]. International journal of gynecological cancer [J]Gynecological Cancer ,2022. 32:662–668.
更多信息,请详询:800-8581156 或 400-889-9853







